Was ist Colitis Ulcerosa?
Colitis Ulcerosa ist eine Autoimmunerkrankung, die primär den distalen (letzten) Teil des Dickdarms (Kolon) betrifft, im Verlauf zu oberen Segmenten fortschreitet, eine chronische Entzündung der Mukosaschicht, die die Innenseite des Kolons auskleidet, umfasst, einen Verlauf mit Perioden von Schüben und Remissionen zeigt und zur Ulkusbildung auf der Schleimhautoberfläche führt.
Was bedeutet Autoimmunerkrankung?
AUTOIMMUNERKRANKUNG ist der allgemeine Begriff für alle Krankheiten, die entstehen, wenn das Abwehrsystem unseres Körpers aufgrund einer durch viele Ursachen bedingten Wahrnehmungsstörung unsere eigenen Gewebe als fremd und/oder schädlich wahrnimmt und sie chronisch angreift und zerstört.
Autoimmunität ist ein Fall der falschen Identität. Das Immunsystem reagiert auf eigene Gewebe und Zellen, als wären sie Krankheitserreger.
Was sind die bekanntesten Autoimmunerkrankungen?
- Colitis Ulcerosa
- Morbus Crohn
- Allergisches Asthma
- Rheumatoide Arthritis
- Systemischer Lupus
- Autoimmune Vaskulitis (Morbus Behçet usw.)
- Multiple Sklerose
- Typ-1-Diabetes
- Usw.
Warum sind Autoimmunerkrankungen wichtig?
Wenn der Prozess, der die Autoimmunität auslöst, nicht stoppt oder nicht gestoppt werden kann, erleichtert jede entstehende Autoimmunerkrankung die Bildung anderer Autoimmunerkrankungen. Man kann dies als Autoimmun-Sturm bezeichnen.
Weltweit sind in den letzten 50 Jahren behandelbare Infektionskrankheiten rapide zurückgegangen, während AUTOIMMUNERKRANKUNGEN lawinenartig zunehmen und weiter zunehmen.
Bei wem tritt Colitis Ulcerosa am häufigsten auf?
Die weltweite jährliche Inzidenzrate der Colitis Ulcerosa wird mit 10-12 pro 100.000 angegeben.
Zwischen Männern und Frauen wurde keine signifikante Prädisposition festgestellt.
Die Häufigkeit des Auftretens nimmt in industrialisierten Gesellschaften zu.
Genetik ist ein wichtiger Faktor. Bei Personen mit Erstgradigen Verwandten mit Colitis Ulcerosa steigt das Risiko auf etwa das 10-12-fache der normalen Bevölkerung, bei eineiigen Zwillingen wird es etwa 95-mal höher.
Industrielle Ernährung ist ein weiterer Risikofaktor. Während das Risiko bei intensivem Konsum von Fleisch und Milchprodukten steigt, reduziert eine gemüsebetonte Ernährung das Risiko.
Intensiver Antibiotikagebrauch und Chemotherapie-Anwendung gehören zu den risikosteigernen Faktoren.
Es ist bekannt, dass das Risiko, im folgenden Jahr eine Colitis Ulcerosa zu entwickeln, bei Personen, die eine Salmonellen- oder Campylobacter-Infektion durchgemacht haben, 8-10-mal höher ist.
Das Risiko ist höher bei Personen mit einer anderen Autoimmunerkrankung.
Was sind die Symptome der Colitis Ulcerosa?
- Blutige Stuhlgänge
- Schleimige Stuhlgänge
- Bauchschmerzen
- Durchfall
- Erhöhte Anzahl von Stuhlgängen
- Tenesmus (ständiges Gefühl des Stuhlgangbedarfs)
- Gewichtsverlust
- Nächtliche Stuhlgänge
- Chronische Müdigkeit
- Schlafstörungen
- Depression
- Sexuelle Dysfunktion
Wie wird Colitis Ulcerosa diagnostiziert?
Bei der Diagnose der Colitis Ulcerosa ist zunächst die allgemeine Untersuchung unter Berücksichtigung klinischer Befunde äußerst wertvoll. Abgesehen von der Untersuchung ist das wertvollste diagnostische Instrument, das uns zur Diagnose führt, die endoskopische Untersuchung durch einen erfahrenen Arzt. Diese endoskopische Untersuchung reicht oft für die Diagnose aus, aber eine Biopsie aus der Dickdarmschleimhaut für die pathologische Untersuchung ist wichtig.
Erhöhte Erythrozyten-Sedimentationsrate und erhöhte CRP-Werte in Bluttests unterstützen die Diagnose.
Erhöhtes Calprotectin und Zonulin in der Stuhluntersuchung unterstützen ebenfalls die Diagnose der Colitis Ulcerosa.
Was ist die grundlegende Pathologie bei Colitis Ulcerosa?
Es ist die Einleitung des chronischen Autoimmunprozesses aufgrund des Verlusts der Biodiversität der Verdauungssystem-Mikrobiota (insbesondere der Kolon-Mikrobiota) und der Schwächung der schützenden Faktoren der Dickdarmschleimhaut.
Der kritische Schwellenwert hier ist die Schädigung der Verdauungssystem-MIKROBIOTA.
Was bedeutet Verdauungssystem-MIKROBIOTA?
Die Sammlung verschiedener Mikroorganismen, die im Verdauungssystem leben, wird kollektiv als Darm-MIKROBIOTA bezeichnet und beeinflusst viele Aspekte der Wirtsphysiologie, einschließlich Nährstoffmetabolismus, Infektionsresistenz und Immunsystementwicklung, tiefgreifend.
Billionen von Mikroorganismen, die die MIKROBIOTA bilden, leben auf den Schleimhäuten (innere Haut), die das Verdauungssystem bedecken, und unterhalten eine symbiotische (gegenseitig vorteilhafte) Beziehung mit dem Immunsystem des Wirts.
Darmbakterien fermentieren unverdauliche Kohlenhydrate, um kurzkettige Fettsäuren (SCFAs) wie Acetat, Propionat und Butyrat zu produzieren. Diese SCFAs wirken als biologisch aktive Verbindungen und liefern Energie für Dickdarm-Epithelzellen. Besonders Butyrat dient als primäre Energiequelle für Dickdarm-Epithelzellen. Da Mikrobiota-Schäden die SCFA-Produktion beeinträchtigen, verliert das Dickdarm-Epithel eine ernsthafte Unterstützung.
POSTBIOTIKUM
Es gibt biologisch aktive Komponenten, die Postbiotika genannt werden, hauptsächlich von Bakterien sezerniert. Unter den Postbiotika bilden Strukturen, die als Oberflächenschichtproteine (SLP) bezeichnet werden, die erste Kontaktlinie mit dem Dickdarminhalt in der Dickdarmschleimhaut. SLP ist eine Komponente der schleimigen Sekretion namens Mukus, die die gesamte Verdauungssystem-Schleimhaut bedeckt.
Die Abnahme der Biodiversität der MIKROBIOTA und ihre Veränderung zugunsten von Pathogenen beeinflusst die aktive Schleimbildung und SLP-Bildung und macht die Dickdarmschleimhaut anfällig für äußere Einflüsse. Dieser Prozess ist die wichtigste Stufe bei der Entstehung der Colitis Ulcerosa.
Wie wird Colitis Ulcerosa behandelt?
Der Zweck der aktuellen Colitis Ulcerosa-Behandlung ist es, die Schubperioden der Krankheit zu unterdrücken, das Auftreten von Schüben zu verhindern und/oder mildere und kürzere Schubperioden zu ermöglichen.
Colitis Ulcerosa ist eine Krankheit, die Anfalls-(Schub-) und Remissionsperioden zeigt. Die Häufigkeit und Dauer von Anfalls- und Remissionsperioden sind von Person zu Person äußerst variabel, da es Hunderte von zugrundeliegenden Faktoren gibt, die diese Variabilität verursachen. Sogar bei derselben Person neigt sie dazu, im Laufe der Zeit einen schwankenden Verlauf zu zeigen.
Die Hauptmedikamente, die bei der Colitis Ulcerosa-Behandlung verwendet werden, sind: 5-Aminosalicylsäure, Kortikosteroide, Azathioprin usw.
Bei all diesen Behandlungen wird die Krankheit nicht vollständig geheilt, nur unterdrückt.
Durch die Beseitigung der Faktoren, die den pathophysiologischen Prozess der Krankheitsentstehung auslösen oder triggern, Schäden an der Dickdarmschleimhaut verursachen und den Autoimmunprozess einleiten, können sowohl Autoimmunprozesse rückgängig gemacht als auch Colitis Ulcerosa behandelt werden. Was dafür getan werden muss, ist die Wiederherstellung der geschädigten Dickdarm-MIKROBIOTA. Die Dickdarm-Mikrobiota-Wiederherstellung kann mit Fäkaler Mikrobiota-Transplantation (FMT) oder Totaler Gastrointestinaler Flora-Transplantation (TGFT), einem spezifischeren Mikrobiota-Wiederherstellungsmodell, durchgeführt werden. Der Zweck der FMT- und TGFT-Behandlung ist es, eine gesunde und hochbiodiversifizierte Mikrobiota wiederherzustellen.
Was ist Fäkale Mikrobiota-Transplantation (FMT)?
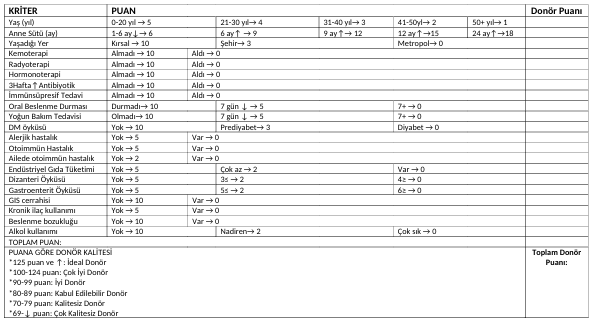
STUHLTRANSPLANTATION ist die Methode der endoskopischen Übertragung von FMT-Transplantat-Material, das nach der Verarbeitung von frischen Fäzes (Stuhl, der höchstens 30 Minuten vor der Transplantation entnommen wurde) von Spenderkandidat(en), die die gesunden Spenderkriterien (Tabellen 1 und 2) erfüllen, durch bestimmte Prozesse gewonnen wurde, in den Dickdarm des Patienten.
Je mehr Spender das FMT-Material vorbereitet wird, desto effektiver wird die FMT-Behandlung sein.
FMT wird mindestens einmal angewendet. Jedoch ist das Ideal für FMT die Anwendung von insgesamt 5 Sitzungen mit 5-7-tägigen Intervallen.
FMT wird endoskopisch im Krankenhaus unter Operationssaal-Bedingungen unter Sedierung/Vollnarkose angewendet.
In jeder FMT-Sitzung müssen mindestens 400 Gramm frische Fäzes verwendet werden.
Der Patient kann 2 Stunden nach der FMT-Anwendung entlassen werden und am selben Tag reisen.
Der Patient kann 2 Stunden nach der FMT-Anwendung mit dem Essen beginnen.
Der Spender muss nicht das gleiche Geschlecht und die gleiche Nationalität wie der Patient haben, noch muss er ein genetischer Verwandter sein.
Was ist FLORA-TRANSPLANTATION (Totale Gastrointestinale Flora-Transplantation: TGFT)?
Es ist der Prozess der Übertragung von Flora-Transplantat-Materialien, die von Spenderkandidat(en), die die gesunden Spenderkriterien (Tabellen 1 und 2) erfüllen, unter Vollnarkose, endoskopisch und koloskopisch, aus etwa 40-45 verschiedenen anatomischen Bereichen entnommen wurden, nach der Verarbeitung durch bestimmte Verfahren, an den Patienten unter Vollnarkose, in den entsprechenden Bereich der Region, aus der es entnommen wurde, durch endoskopische und koloskopische Methoden.
Eine einzige TGFT-Sitzung ist ausreichend.
Nach TGFT können Spender nach 8 Stunden entlassen werden. Patienten werden einen Tag nach der TGFT-Durchführung entlassen. Nach der Entlassung können sowohl Spender als auch Patient am selben Tag reisen. Patienten beginnen 4 Stunden nach TGFT mit dem Essen. Spenderkandidaten können 2 Stunden nach dem Verfahren mit dem Essen beginnen.
Solange bei Patienten, die sich einer TGFT unterziehen, keine außergewöhnlichen Entwicklungen auftreten, ist das durchgeführte Transplantat lebenslang dauerhaft.
Da Mikrobiota-Proben, die aus 45 verschiedenen Regionen in TGFT entnommen wurden, in entsprechende Regionen transplantiert werden, ist es ein regional spezifisches Verfahren. Bei FMT gibt es jedoch keine regionale Spezifität.
Der Zweck der TGFT-Durchführung ist es, die gesamte Verdauungssystem-Flora (Mikrobiota) vom Mund bis zum Anus wiederherzustellen. FMT zielt nur darauf ab, die Dickdarm-Flora (Mikrobiota) wiederherzustellen.
Was ist der Zweck der Durchführung von FMT und TGFT?
Das Ziel ist eine kurative Behandlung. Aber auch wenn dies nicht erreicht werden kann, ist es wichtig, Symptome während Anfallsperioden zu lindern, Anfall-Dauern zu verkürzen und Anfall-Häufigkeiten zu reduzieren.
Häufige Defäkation und ständiges Gefühl des Defäkationsbedarfs (Tenesmus) verursachen soziale Isolation bei Patienten, sie können nicht sehr weit von zu Hause oder vom Arbeitsplatz entfernt gehen und können besonders keine langfristigen öffentlichen Verkehrsmittel nutzen. Mit durchzuführender FMT oder TGFT wird die tägliche Anzahl der Defäkationen abnehmen und Durchfall wird kontrolliert werden, so dass sie sich viel komfortabler bewegen können. Für Patienten, die aus Angst, die Defäkation nicht kontrollieren zu können, nicht ausgehen können, nicht zum Markt oder zu Nachbarn gehen können, sind TGFT und FMT ein sehr ernster Hoffnungsschimmer.
Da der Bedarf an nächtlicher Defäkation mit FMT oder TGFT minimiert wird, werden chronische Müdigkeits- und Depressionssymptome zusammen mit besserer Schlafqualität abnehmen.
Doz. Dr. Murat KANLIÖZ
Facharzt für Allgemeinchirurgie
Tabelle 1: Ausschlusskriterien für die Spenderauswahl bei der Totalen Gastrointestinalen Flora-Transplantation
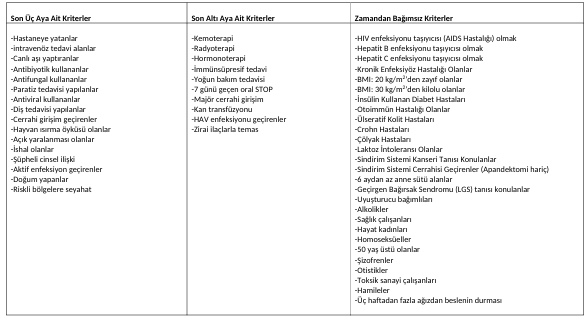
Tabelle 2: Spender-Qualitätsbewertung